北理工课题组在蛋白自组装领域重要研究进展
发布日期:2023-08-08 供稿:生命学院 摄影:生命学院
编辑:肖雯 审核:周连景 阅读次数:
近日,乐动(中国)霍毅欣教授团队在蛋白自组装领域发表重要综述(https://doi.org/10.1016/j.tibtech.2023.06.009),发表在《Trends in Biotechnology》(影响因子:17.2996)。该工作以乐动(中国)为第一通讯单位,副研究员陈振娅为第一作者,霍毅欣教授为通讯作者,博士生毋彤、于盛竹,硕士生李敏、樊泫何为参与作者。
酶自组装是指目标酶可在蛋白自组装支架的辅助下聚集形成有序的大分子技术(图1)。在代谢工程中,自组装策略已被用于聚集同一途径中多个酶,以提升多个酶的顺序催化效率,进而提升整条途径的代谢通量,增强目标产物合成效率,实现高水平生产。蛋白自组装支架的性能对高效稳定的多酶组装系统的构建至关重要。本文首先分析了代谢工程现阶段生产遇到的难题,随后阐述了自组装支架在解决代谢工程难题中的应用优势。随后,将现有代谢工程领域应用的蛋白自组装支架进行了分类,并对不同支架的组装方式进行了综合分析。接着,阐述了自组装支架在代谢工程领域不同模块的应用场景,包括提高单个酶的催化效率,提升多酶级联的顺序催化效率,减少副反应及加强辅因子的供应等。此外,本文分析了现有自组装支架的不足,阐述了不同支架的组装性能,提出了针对不同支架的性能改进策略,为高效微生物细胞工厂的构建提供了新思路。
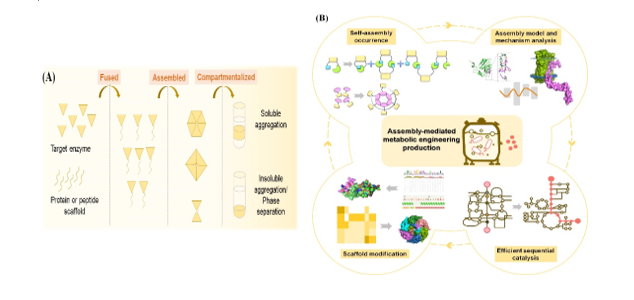
图1 酶自组装及自组装介导的代谢工程生产
上述综述是对本团队近年来利用蛋白自组装支架在代谢流调控方面的开发及应用的总结和分析,相关工作如下:
1. 利用自组装支架构建新型蛋白固定化方法
体外生物合成因其过程可控及转化效率高等特点已经成为生产高值化合物的一种极具吸引力的方法。体外生物合成过程中,酶的可重复利用对于节省成本和提高合成效率至关重要。酶固定化是实现酶重复利用的简单直接方法。简便易行的酶固定化方法可快速高效实现酶的固定化。基于此,申请人以食品生产香料的重要前体物异丁醛体外生物合成为例,利用CipA的自组装特性建立了一步自组装的固定化策略,利用此策略实现了缬氨酸到异丁醛合成途径相关酶LeuDH和KivD的固定化。结构模拟结果表明,CipA介导的酶固定化不影响目标酶的结构和催化机制(图2)。与游离酶相比,固定化酶具有更高的转化能力和热稳定性。此外,批次转化实验表明,使用多轮后回收的固定化酶具有与第一轮反应中固定化酶相近的转化能力。随后,通过搭建连续生产装置,同时将固定化酶装载到连续生产装置中,实现了异丁醛的体外连续生产。此项工作不仅拓展了自组装系统的应用范围,而且为体外生产高值化合物提供了指导。相关研究成果发表在 Journal of Agricultural and Food Chemistry (影响因子:6.1004)杂志上(In vitro biosynthesis of isobutyraldehyde through the establishment of a one-step self-assembly-based immobilization strategy.)。副研究员陈振娅与硕士生赵璐瑶为共同第一作者,霍毅欣教授与陈振娅副研究员为共同通讯作者。

图2 CipA-KivD-LeuDH与底物的复合物模型
2. 利用自组装支架重导细胞代谢流
邻苯三酚是一种具有多种生理功能和药物价值的酚类化合物。申请人在大肠杆菌中成功构建了以葡萄糖为初始碳源的邻苯三酚非天然生物合成途径。在生物合成过程中,关键前体物4-羟基苯甲酸先被Y385F/T294A PobA催化生成3,4-二羟基苯甲酸,3,4-二羟基苯甲酸再被Y385F/T294A PobA进一步催化生成没食子酸,随后脱羧酶PDC对没食子酸进行脱羧反应生成邻苯三酚。脱羧酶PDC的底物多样性导致其也会对中间产物3,4-二羟基苯甲酸进行脱羧反应,进而生成副产物儿茶酚。在组装完整途径并转化到宿主菌中发酵后发现邻苯三酚产量很低,副产物儿茶酚产量很高,说明Y385F/T294A PobA催化3,4-二羟基苯甲酸到没食子酸的过程不够迅速,导致大量的碳源流向了副产物儿茶酚的生产途径。于是,申请人借鉴了CipA的自组装特性,将CipA与合成途径中的关键限速酶Y385F/T294A PobA融合形成融合蛋白(Y385F/T294A PobA-CipA或CipA-Y385F/T294A PobA),随后融合蛋白在胞内聚集形成包涵体(图3)。聚集后的Y385F/T294A PobA加快了4-羟基苯甲酸到没食子酸的两步转化,降低了脱羧酶PDC对3,4-二羟基苯甲酸的催化,提高了目标产物邻苯三酚的产量。相关研究成果发表在 Applied Microbiology and Biotechnology (影响因子:5.0002)杂志上(CipA-mediating enzyme self-assembly to enhance the biosynthesis of pyrogallol in Escherichia coli .)。陈振娅副研究员为通讯作者。
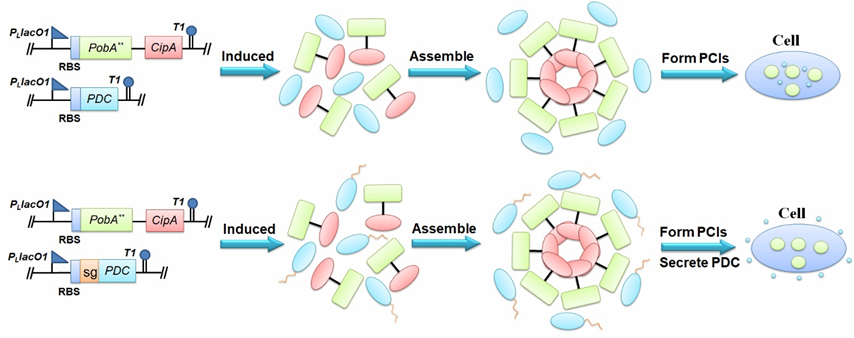
图3 自组装聚集Y385F/T294A PobA
3. 基于自组装支架构建新型蛋白纯化方法
常用的传统蛋白分离纯化方法是亲和纯化,其依赖于对亲和层析柱的使用。亲和纯化的成本高,与大规模生产不适配,同时利用亲和纯化得到的蛋白带有纯化标签,而纯化标签会影响靶蛋白活性。因此,为了节省蛋白纯化成本,简化纯化步骤,同时使靶蛋白维持原有特性,申请人设计开发了一种自组装蛋白纯化方法,这种蛋白纯化方法依赖于一种双功能纯化标签CipA-DnaB,此标签同时具有自组装和自裂解功能,将此标签与靶蛋白融合即可纯化得到无标签靶蛋白,且靶蛋白能够保持原有活性。CipA-DnaB标签是由自组装蛋白CipA和内含肽蛋白 Ssp DnaB融合得到,其中CipA可自发组装形成蛋白包涵体, Ssp DnaB是一种在弱酸条件下C端可发生自裂解的短内含肽。将此双功能标签与靶蛋白融合后,靶蛋白会在CipA的引导下进行自组装(图4),随后仅需离心和自裂解步骤即可快速纯化得到可溶的无标签靶蛋白。接着,为了提高蛋白纯化效率,优化了CipA与 Ssp DnaB之间的连接肽和自裂解条件,结果显示利用柔性连接肽同时在裂解液中添加EDTA能够显著提高蛋白纯化效率。为了验证此自组装蛋白纯化方法的普适性,利用此方法纯化了MBP、KivD和AdhP,同时检测了纯化后的KivD和AdhP酶活性,结果显示纯化后的KivD和AdhP仍然具有较高的比酶活。此项工作建立的新型自组装纯化方法可为工业蛋白纯化提供一种成本低且有效的选择。相关研究成果发表在 Journal of Biotechnology (影响因子:4.0998)杂志上。(A novel protein purification strategy mediated by the combination of CipA and Ssp DnaB intein.)副研究员陈振娅与硕士生赵璐瑶为共同第一作者,霍毅欣教授与陈振娅副研究员为共同通讯作者。

图4 CipA-DnaB在大肠杆菌中组装eGFP
该项工作得到了国家自然科学基金和中央高校基本科研业务费专项资金的支持,也感谢乐动(中国)生物与医学工程公共实验中心的支持。
分享到:
